Molekul Metana
(CH4), Pada tingkat dasar, atom karbon sebagai atom pusat dengan
nomor atom 6 mempunyai konfigurasi elektron = 1s2
2s2 2p2
Diagram orbital atom
C
Dari diagram
orbital, hanya ada dua elektron yang tidak berpasangan (elektron yang dapat
digunakan untuk berikatan kovalen) jadi seharusnya atom C hanya dapat berikatan
dengan dua atom H membentuk CH2. Tetapi kenyataannya senyawa CH2
tidak ada, yang ada adalah CH4.
Pembentukan
molekul CH4 dapat dijelaskan dengan teori hibridisasi. Tahapan
pembentukan ikatan dalam molekul CH4 sebagai berikut:
Gambar 2.8. Diagram
pembentukan orbital hibrida sp3 dan geometri molekul CH4
Teori ini
menjelaskan adanya promosi satu elektron dari orbital 2s ke orbital 2pz
membentuk empat orbital baru yang setingkat. Orbital tersebut dinamakan orbital
hibrida sp3. Kemudian terjadi empat ikatan C-H akibat adanya
pertindihan orbital 1s dari hidrogen dengan orbital sp3 dari karbon membentuk
geometri tetrahedral.
Dari penjelasan tersebut, penentuan geometri
molekul menurut teori hibridisasi atau teori ikatan valensi didasarkan
bagaimana atom-atom membagi elektron saat terjadinya ikatan. Bila dua atom
berikatan secara kovalen, orbital salah satu atom akan mengalami tumpang tindih
(overlap) dengan orbital atom lainnya. Pasangan elektron akan dibagi diantara
kedua orbital yang tumpang tindih sehingga kepadatan elektron akan terkumpul
diantara inti atom-atom yang berikatan, seperti pada gambar 2.8.
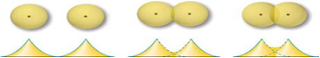
Gambar 2.9. tumpang
tindih antara orbital 1s.
Teori
hibridisasi dapat dikatakan sebagai suatu teori peleburan orbital-orbital dari
tingkat energi yang berbeda menjadi orbital-orbital yang setingkat. Secara umum
berbagai tipe hibridisasi dan geometri molekulnya dapat dilihat pada tabel 2.2.
Orbital hibrida
|
Jumlah pasangan
ikatan
|
Geometri molekul
|
Sudut ikatan
|
Contoh molekul
|
sp
|
2
|
Linier
|
1800
|
BeCl2
|
sp2
|
3
|
Segitiga datar
|
1200
|
BCl3
|
sp3
|
4
|
Tetrahedral
|
109,50
|
CH4,
CCl4
|
dsp2
|
4
|
Segiempat datar
|
900
|
Ni(CN)42-
|
dsp3,
sp3d
|
5
|
Segitiga
bipiramida
|
1200
(equilateral) dan 900 (aksial)
|
PCl5
|
d2sp3,
sp3 d2
|
6
|
Oktahedral
|
900
|
Fe(CN)63-,
SF6
|
Tabel 2.2. beberapa
bentuk geometri molekul menurut teori hibridisasi
Contoh;
Menurut teori VSEPR,
Molekul PCl5 diketahui berbentuk bipiramida segitiga. Bagaimanakah
bentuk molekul PCl5 berdasarkan teori hibridisasi?
Orbital sp3d
berikatan dengan 5 orbital 3p dari Cl membentuk geometri bipiramida segitiga







Tidak ada komentar:
Posting Komentar