MARI LAKUKAN
Perhatikan gambar
10.5.1 pada sampul!
Apakah Anda pernah
menggunakan asam sulfat (H2SO4) pada aki kendaraan Anda?
 |
Gambar 10.5.2 Kerusakan pada kain akibat larutan asam
sulfat |
Perhatikan
gambar 10.5.2! Asam sulfat dapat merusak kain, apalagi kulit Anda… Jadi berhati-hatilah
saat menggunakannya karena akan merusak jaringan kulit Anda dan akan
meninggalkan luka bakar.
Apakah
keasaman asam sulfat sama dengan asam
cuka?
Dan
dapatkah fungsi asam sulfat dalam aki digantikan oleh larutan asam yang
lainnya?
Dapatkah
Anda menjawabnya? Diskusikanlah bersama beberapa temanmu dengan menggunakan
berbagai artikel dan semua pengalaman belajar yang sudah dimiliki.
Kekuatan
asam basa dapat ditunjukkan dengan hasil pengukuran daya hantar listrik suatu
larutan. Anda masih ingat percobaan larutan elektrolit saat di kelas X? Cobalah Anda lakukan lagi dengan menggunakan
larutan aki dan cuka.
Apakah
hasil percobaan Anda seperti tampak pada gambar 10.5.3! Manakah yang
menunjukkan hasil uji daya hantar listrik untuk larutan elektrolit kuat? Apakah
Anda dapat menyebutkan perbedaan larutan elektrolit kuat dan elektrolit lemah?
 |
Gambar 10.5.3 Hasil uji larutan elektrolit |
MARI BERBAGI
Bagikanlah
pengalaman belajar yang Anda miliki mengenai elektrolit lemah dan elektrolit
kuat dengan beberapa teman.
Namun, untuk lebih memperkuat pemahaman Anda, mari kita pelajari
penjelasan larutan elektrolit seperti pada gambar 10.5.3!
Larutan
elektrolit kuat memberikan nyala lampu yang lebih terang dibandingkan dengan
elektrolit lemah. Hal ini dikarenakan jumlah ion yang dihasilkan dari reaksi
ionisasi larutan elektrolit kuat lebih banyak (reaksi ionisasi sempurna, α = 1)
Begitu pula
larutan asam atau basa kuat pada umumnya mempunyai daya hantar listrik yang
lebih kuat dibandingkan larutan asam atau basa lemah.
Selain itu
berdasarkan konsep yang Anda peroleh pada materi terkait pH, Anda telah
mengetahui bahwa setiap larutan akan mempunyai konsentrasi H+ dan OH-
yang berbeda. Hal inilah yang menyebabkan kekuatan asam dan basa tiap larutan
berbeda pula.
Sebagai contoh
asam kuat adalah asam klorida atau hidrochloric acid (HCl). Ionisasi asam klorida merupakan reaksi irreversibel atau reaksi berkesudahan.
Sedangkan contoh
asam lemah adalah asam fluorida atau Hidroflouric
acid. Reaksi asam ini termasuk reaksi reversibel
atau reaksi bolak-balik. Asam fluorida hanya terionisasi sebagian sehingga
derajat ionisasinya sangat kecil atau mendekati nilai 0.
Jadi,
dapatkah Anda menemukan perbedaan dari asam kuat dan asam lemah berdasarkan
tayangan tersebut?
Perbedaan
asam kuat dan asam lemah bergantung pada banyak dan sedikitnya ion H+
(atau ion hidronium, H3O+ . ingat! H+ dan H3O+ adalah senyawa
yang sama) yang dihasilkan dalam reaksi ionisasi suatu senyawa asam.
Kebanyakan
asam kuat merupakan asam anorganik seperti asam nitrat (HNO3), asam
sulfat (H2SO4), asam perklorat (HClO4), asam
iodida (HI), asam bromida (HBr).
Misalnya,
rumus asam kuat HyA dengan konsentrasi M molar dan α = 1 mengalami ionisasi sebagai
berikut:
Berdasarkan
reaksi tersebut, diperoleh:
Namun,
pada umumnya senyawa asam hanya sedikit terionisasi dalam air. Asam seperti ini
termasuk dalam asam lemah.
Pada
reaksi kesetimbangan asam fluorida, larutan asam fluorida terdiri dari H+,
F-, dan asam fluorida yang tidak terionisasi sehingga tetapan
ionisasi asamnya dapat dirumuskan sebagai berikut:
Makin
kuat asam maka reaksi kesetimbangan makin condong ke arah kanan sehingga harga
Ka akan semakin besar. Oleh karena itu, harga Ka merupakan ukuran kekuatan
asam. Makin besar Ka maka makin kuat pula keasamannya. Beberapa harga Ka pada
suhu 250C diberikan pada tabel 10.5.1.
 |
Tabel 10.5.1 tetapan ionisasi asam lemah |
Bagaimana
hubungan antara konsentrasi asam, derajat ionisasi, dan tetapan ionisasi suatu
asam lemah?
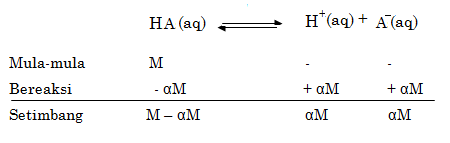
Jika
asam lemah secara umum dirumuskan sebagai HA dengan konsentrasi M dan derajat
ionisasi α. Maka dapat
ditentukan hubungan ketiganya sebagai berikut:
Perhatikanlah
reaksi asam lemah berikut ini!
Karena
asam lemah mengalami reaksi kesetimbangan, maka dapat dirumuskan tetapan
kesetimbangan sebagai berikut:
Kc
untuk asam diganti dengan Ka (tetapan ionisasi asam)
Misalnya,
konsentrasi asam lemah HA dinyatakan dalam M, maka:
Jadi, pada saat setimbang
Derajat
ionisasi asam lemah dapat ditentukan melalui persamaan berikut:
Jadi
dapat diperoleh rumusan untuk memperoleh [H+] asam lemah:
Dan
rumusan untuk memperoleh nilai α
asam lemah:
Keterangan:
[H+] =
Konsentrasi ion Hidrogen
Ka = Tetapan ionisasi asam
α = Derajat ionisasi asam
M = Konsentrasi larutan asam
Perlu Anda
ketahui walaupun asam lemah poliprotik mempunyai Ka lebih dari satu, pada
perhitungan biasanya hanya menggunakan harga Ka pada ionisasi pertama.
Nah…,
berdasarkan penjelasan tersebut dan hasil diskusi Anda dengan beberapa teman. Coba
Anda ingat kembali permasalahan di awal
kegiatan pembelajaran kita.
Anda
pasti sudah tahu bahwa keasaman asam sulfat berbeda dengan asam cuka.
Mari
analisis hasil jawabannya!
Pada
kegiatan belajar tentang asam basa Arrhenius Anda sudah memahami bahwa asam
sulfat (H2SO4) merupakan asam diprotik sehingga akan
mengalami dua tahapan ionisasi.
Pada
tahap pertama asam sulfat akan terionisasi sempurna, berarti semua terionisasi
atau derajat ionisasinya sama dengan 1. Pada tahap kedua, HSO4-
tidak terionisasi sempurna sehingga pada reaksi kesetimbangan masih terdapat
HSO4-, H+, dan SO42-.
Namun, diasumsikan bahwa H+ yang dihasilkan semuanya diperoleh pada
tahap pertama, maka H2SO4 tetap dikategorikan asam kuat.
Sedangkan
asam cuka atau asam asetat terionisasi sebagian dalam air.
Ini
berarti hanya sedikit H+ yang dihasilkan dalam reaksi ionisasi asam
cuka dibandingkan asam sulfat. Jadi asam cuka keasamannya lebih lemah
dibandingkan asam sulfat.
Cobalah
Anda perhatikan contoh soal berikut untuk membuktikan bahwa pada konsentrasi
yang sama, asam sulfat memiliki konsentrasi ion H+ yang lebih besar
dibandingkan asam asetat.
Bagaimana dengan
larutan basa? Dapatkah Anda menjelaskan perbedaan basa kuat dengan basa lemah?
Agar Anda lebih mudah membandingan basa kuat dan basa lemah cobalah Anda perhatikan Gambar 10.5.4 tentang reaksi ionisasi basa kuat dan basa lemah.
 |
Gambar 10.5.4 Hasil reaksi ionisasi pada larutan basa |
Pembahasan
mengenai asam kuat berlaku juga untuk basa kuat. Basa kuat pada umumnya
merupakan senyawa hidroksida dari logam alkali dan logam alkali tanah seperti
kalium hidroksida (KOH), natrium hidroksida (NaOH), barium hidroksida (Ba(OH)2),
magnesium hidroksida (Mg(OH)2).
Basa
kuat merupakan larutan elektrolit kuat yang dapat terionisasi sempurna seperti
tampak pada gambar 10.4.4 bagian (A). NaOH terionisasi seluruhnya menjadi Na+
dan OH-.
Sama halnya
dengan asam lemah, basa lemah merupakan elektrolit lemah. Basa lemah hanya
terionisasi sebagian. Salah satu contoh basa lemah adalah larutan amonia yang
hanya terionisasi sedikit dalam air.
Perhatikan gambar 10.5.4 bagian (B)! Pada reaksi tersebut
selain NH4+ dan OH-, masih terdapat NH3 yang
tidak terionisasi. Dengan demikian, dapat dirumuskan tetapan ionisasi basanya
(Kb).
Makin
kuat basa maka reaksi kesetimbangan makin condong ke arah kanan sehingga harga
Kb akan semakin besar. Oleh karena itu, makin besar Kb maka senyawa tersebut
semakin basa. Beberapa harga Kb pada suhu 250C diberikan pada tabel
10.5.2.
 |
Tabel 10.5.2 tetapan ionisasi basa lemah |
Sebagaimana asam
lemah, hubungan antara [OH‑], konsentrasi basa lemah (M), derajat
ionisasi basa (α), dan
tetapan ionisasi suatu basa (Kb) dapat dirumuskan sebagai berikut:
Keterangan:
[OH-]
= Konsentrasi ion hidroksida
Kb = Tetapan ionisasi basa
α =
Derajat ionisasi
M = Konsentrasi larutan basa
Berdasarkan
penjelasan tersebut, bagaimana menurut Anda hubungan kekuatan asam basa dengan
harga pH suatu larutan?
Jadi,
dapat disimpulkan bahwa kekuatan asam dan basa sangat bergantung pada kemampuan
asam dan basa tersebut terionisasi dalam air. Konsep asam dan basa seperti ini
didasarkan pada teori asam basa Arrhenius.
Bagaimana
kekuatan asam basa menurut Bronsted- Lowry?
Menurut
Bronsted-Lowry, asam kuat adalah zat yang mudah melepaskan proton. Sedangkan
basa kuat adalah zat yang relatif lebih mudah menarik proton.
Asam klorida (HCl) merupakan asam kuat dibandingkan asam asetat (CH3COOH) sehingga ketika kedua asam tersebut dicampurkan, asam klorida akan cenderung memberikan protonnya.
Namun, ketika CH3COOH
bereaksi dengan H2O maka yang memberikan protonnya adalah CH3COOH.
Dan
H2O akan menjadi lebih asam jika bereaksi dengan amonia (NH3)
sehingga akan memberikan protonnya.
Jadi,
kekuatan asam dan basa menurut Bronted-Lowry bersifat relatif bergantung dengan
zat yang menjadi lawan reaksinya. Semakin kuat asamnya maka basa konjugasinya
semakin lemah
Kekuatan
relatif pasangan asam-basa konjugasi dapat dilihat pada tabel 10.5.3.
 |
Tabel 10.5.3 Kekuatan relatif asam dan basa konjugasi |
Setelah
berdiskusi tentang kekuatan asam dan basa, apakah yang dapat Anda simpulkan?
MARI PAHAMI
MARI BERAKSI
Selamat mengerjakan dan sukses!
Jawablah pertanyaan dibawah ini!
1.
Seorang laboran akan menata ulang letak larutan
asam dan basa di lemari bahan. Cobalah Anda membantu dengan mengelompokkan
manakah larutan yang termasuk asam kuat, asam lemah, basa kuat, dan basa lemah
dari beberapa larutan berikut ini.
a.
Hidrochloric acid (HCl)
b.
Magnesium hidroksida (Mg(OH)2)
c.
Soda kaustik (NaOH)
d.
Amonia (NH3)
e.
Asam formiat
(HCOOH)
f.
Asam nitrat
(HNO3)
g.
Fenol (C6H5OH)
2.
Anda diberikan dua gelas kimia yang
masing-masing berisi larutan asam kuat (HA) dan larutan asam lemah (HB) dengan
konsentrasi yang sama. Jelaskan bagaimana Anda membandingkan kekuatan kedua
asam dengan;
a.
Mengukur hantaran listrik.
b.
Laju pembentukan gas hidrogen bila
larutan-larutan tersebut direaksikan dengan logam aktif seperti seng.
c.
pH larutan
3. Soft drink merupakan contoh
kesetimbangan yang terjadi antara molekul dan ion. Di dalam minuman tersebut
terdapat asam karbonat H2CO3 (Ka1 = 4.3 x 10-7
dan Ka2 = 5.6 x 10-11 ). Jika konsentrasi H2CO3
dalam minuman sebesar 1 x 10-3 M, hitunglah konsentrasi ion H+
nya!
MARI TERAPKAN
Jawablah pertanyaan dibawah ini!
Kini kehidupan di kota-kota besar seperti Jakarta sungguh sangat
memperihatinkan, polusi dan pencemaran dimana-mana termasuk kondisi airnya. Sungai
yang biasanya menjadi sumber kehidupan berubah menjadi selokan sampah raksasa
yang membuat air di kota tersebut beraroma busuk.
Dari tajuk tersebut dapat Anda
analisis dan jawab:
1. Apa
saja sumber-sumber pencemaran air di kota-kota besar?
2. Jelaskan
beberapa solusi dalam mengurangi tingkat pencemaran air di kota-kota besar?
KIMIA BERKARAKTER
Setiap senyawa asam dan basa mempunyai kekuatan yang berbeda bergantung banyak sedikitnya ion H+ untuk asam dan OH- untuk basa.
Makin banyak ion H+ yang dihasilkan dalam reaksi ionisasinya, maka
semakin kuat keasamannya. Sedangkan jika dalam ionisasi semakin banyak ion OH-
maka semakin basalah larutan senyawa tersebut.
Begitupun manusia, ciri yang akan ada pada diri kita
bergantung dengan apa yang kita perlihatkan dalam menjalani kehidupan. Jika
malas yang selalu kita jalani maka kita menjadi anak pemalas, sering bohong
maka menjadi pembohong. Namun jika
Anda rajin belajar maka menjadi anak
yang pintar, rajin beribadah maka kita
menjadi anak yang disayang oleh Tuhan,
dan semua lebel yang ada dalam diri kita karena apa yang telah kita lakukan.
Jadi jika Anda ingin menjadi orang yang kuat, secara
fisik dan mental, teruslah berusaha…Jangan selalu berada dalam lingkaran yang
dapat membelenggumu. Jadikanlah belenggu dan masalah dalam hidupmu kekuatan
untuk menjadi yang terbaik. dan jadikanlah Al-Quran sebagai petunjukmu agar
mendapatkan Rahmat-Nya.
Keluarlah dari garis masalah yang membelenggumu dan
jadilah yang terbaik
Apa yang Anda peroleh adalah apa yang telah Anda
usahakan.
Jadi…sebagai para peneliti muda, teruslah berkarya
untuk kebaikan bangsa. Anda dapat melihat film pendek ini untuk menjadi
motivasi dalam perjalanan mencapai cita-cita.
Selamat menyaksikan…..
Sumber :
https://www.youtube.com/watch?v=S-AA3TxUCEwHASIL AKSI
Jika nilai yang Anda peroleh lebih
besar dari 75 maka Anda dapat melanjutkan ke materi Indikator asam basa. Namun, jika
nilai Anda dibawah 75 maka Anda harus mencoba mengulang kembali mempelajari materi kekuatan asam dan basa
S E M A N G A T…!
INFORMASI LEBIH LANJUT
GLOSARIUM
|
|
|
|
Derajat
ionisasi |
perbandingan
banyaknya jumlah zat yang terionisasi dengan jumlah zat mula-mula |
|
|
|
|
Larutan
elektrolit |
larutan
yang mengandung ion-ion sehingga dapat menghantarkan arus listrik |
|
|
|
|
Tetapan
kesetimbangan |
hasil
kali konsentrasi zat –zat hasil reaksi dibagi hasil kali konsentrasi zat-zat
pereaksi yang masing-masing dipangkatkan dengan koefisien reaksinya adalah
tetap |
|
|
|
SUMBER GAMBAR
1.
Aki mobil : http://anneahira.com
2.
Dampak asam sulfat : http://wikipedia.org
3.
Larutan elektrolit : http://enerypted.tbn1.gstatic.com
TAYANGAN VIDEO
1. Ionisasi
asam kuat : http://youtube.com
2. Ionisasi
asam lemah : http://youtube.com
FILM PENDEK
Motivasi hidup jangan pernah menyerah:
https://www.youtube.com/watch?v=S-AA3TxUCEw
DAFTAR PUSTAKA
James E. Brady. 1998. Kimia Universitas Azas & Struktur (General Chemistry Principles & Structure).
Edisi Kelima. Jilid satu. Diterjemahkan oleh: Sukmariah Maun, dkk. 1998.
Jakarta: Binarupa Aksara
John.A.Olmsted &
Gregory.M.Williams. 2005. CHEMISTRY.
Edisi keempat. John willey & Sons.inc
Raymond Chang. 2003. Kimia Dasar: Konsep-konsep Inti (General Chemistry: The Essential Concepts).
Edisi Ketiga. Jilid satu. Diterjemahkan oleh Suminar Setiati Achmadi. 2005.
Jakarta: Erlangga
Ralph. H. Petrucci. 1985. Kimia Dasar: Prinsip dan Terapan Modern.
Edisi keempat. Jilid dua. Diterjemahkan oleh Suminar
Achmadi,Ph.d.1987.Jakarta:Erlangga
Saptono Nugrohadi dan Sukisman
Purtadi. 2007. Kimia 2 untuk SMA/MA Kelas
XI. Edisi Pertama. Jakarta: Balai Pustaka
Sutrisna dan Lisa Listiani. 2006. Spektrum Kimia untuk SMA/MA Kelas XI IPA. Bandung


















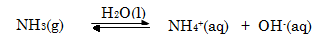









Tidak ada komentar:
Posting Komentar